![]() Обмен веществ
Обмен веществ
Метаболи́зм, или обме́н веще́ств, — это химические реакции, поддерживающие жизнь в живом организме. Эти процессы позволяют организмам расти и размножаться, сохранять свои структуры и отвечать на воздействия окружающей среды.
Метаболизм обычно делят на 2 стадии: катаболизм и анаболизм. В ходе катаболизма сложные органические вещества деградируют до более простых, обычно выделяя энергию, а в процессах анаболизма — более сложные вещества синтезируются из более простых с затратами энергии.
Серии химических реакций обмена веществ называют метаболическими путями. В них, при участии ферментов, одни биологически значимые молекулы последовательно превращаются в другие.
Ферменты играют важную роль в метаболических процессах, потому что:
- действуют как биологические катализаторы и снижают энергию активации химической реакции;
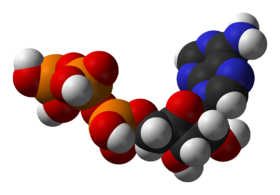 Структура аденозинтрифосфата — главного посредника в энергетическом обмене веществ
Структура аденозинтрифосфата — главного посредника в энергетическом обмене веществ - позволяют регулировать метаболические пути в ответ на изменения среды клетки или сигналы от других клеток.
Особенности метаболизма влияют на то, будет ли пригодна определённая молекула для использования организмом в качестве источника энергии. Так, например, некоторые прокариоты используют сероводород в качестве источника энергии, однако этот газ ядовит для животных[1]. Скорость обмена веществ также влияет на количество пищи, необходимой для организма.
![]()
![]() Эволюционные аспекты метаболизма
Эволюционные аспекты метаболизма![]() Править
Править
Основные метаболические пути и их компоненты одинаковы для многих видов, что свидетельствует о единстве происхождения всех живых существ[2]. Например, некоторые карбоновые кислоты, являющиеся интермедиатами цикла трикарбоновых кислот, присутствуют во всех организмах, начиная от бактерий и заканчивая многоклеточными организмами эукариот[3]. Сходства в обмене веществ, вероятно, связаны с высокой эффективностью метаболических путей, а также с их ранним появлением в истории эволюции[4][5].
![]()
![]() Биологические молекулы
Биологические молекулы![]() Править
Править
Органические вещества, входящие в состав всех живых существ (животных, растений, грибов и микроорганизмов), представлены в основном аминокислотами, углеводами, липидами (часто называемые жирами) и нуклеиновыми кислотами. Так как эти молекулы имеют важное значение для жизни, метаболические реакции сосредоточены на создании этих молекул при строительстве клеток и тканей или разрушении их с целью использования в качестве источника энергии. Многие важные биохимические реакции объединяются вместе для синтеза ДНК и белков.
| Тип молекулы | Название формы мономера | Название формы полимера | Примеры форм полимера |
|---|---|---|---|
| Аминокислоты | Аминокислоты | Белки (полипептиды) | Фибриллярные белки и глобулярные белки |
| Углеводы | Моносахариды | Полисахариды | Крахмал, гликоген, целлюлоза |
| Нуклеиновые кислоты | Нуклеотиды | Полинуклеотиды | ДНК и РНК |
![]()
![]() Аминокислоты и белки
Аминокислоты и белки![]() Править
Править
Белки являются биополимерами и состоят из остатков аминокислот, соединённых пептидными связями. Некоторые белки являются ферментами и катализируют химические реакции. Другие белки выполняют структурную или механическую функцию (например образуют цитоскелет)[6]. Белки также играют важную роль в передаче сигнала в клетках, иммунных реакциях, агрегации клеток, активном транспорте через мембраны и регуляции клеточного цикла[7]. Аминокислоты также способствуют клеточному энергетическому метаболизму, обеспечивая источник углерода для входа в цикл лимонной кислоты (цикл трикарбоновых кислот)[8], особенно когда основного источника энергии, такого как глюкоза, недостаточно, или когда клетки подвергаются метаболическому стрессу[9].
![]()
![]() Липиды
Липиды![]() Править
Править
Липиды — это самая разнообразная группа биохимических веществ. Они входят в состав биологических мембран, например плазматических мембран, являются компонентами коферментов и источниками энергии.[7] Липиды представляют собой полимеры жирных кислот, которые содержат длинную неполярную углеводородную цепь с небольшой полярной областью, содержащей кислород. Липиды являются гидрофобными или амфифильными биологическими молекулами, растворимыми в органических растворителях, таких как бензол или хлороформ[10]. Жиры — большая группа соединений, в состав которых входят жирные кислоты и глицерин. Молекула трёхатомного спирта глицерина, образующая три сложные эфирные связи с тремя молекулами жирных кислот, называется триглицеридом[11]. Наряду с остатками жирных кислот, в состав сложных липидов может входить, например, сфингозин (сфинголипиды), гидрофильные группы фосфатов (в фосфолипидах). Стероиды, например холестерол, представляют собой ещё один большой класс липидов[12].
![]()
![]() Углеводы
Углеводы![]() Править
Править

Сахара могут существовать в кольцевой или линейной форме в виде альдегидов или кетонов, имеют несколько гидроксильных групп. Углеводы являются наиболее распространёнными биологическими молекулами. Углеводы выполняют следующие функции: хранение и транспортировка энергии (крахмал, гликоген), структурная (целлюлоза растений, хитин у грибов и животных)[7]. Наиболее распространёнными мономерами сахаров являются гексозы — глюкоза, фруктоза и галактоза. Моносахариды входят в состав более сложных линейных или разветвлённых полисахаридов[13].
![]()
![]() Нуклеотиды
Нуклеотиды![]() Править
Править
Полимерные молекулы ДНК и РНК представляют собой длинные неразветвлённые цепочки нуклеотидов. Нуклеиновые кислоты выполняют функцию хранения и реализации генетической информации, которые осуществляются в ходе процессов репликации, транскрипции, трансляции и биосинтеза белка[7]. Информация, закодированная в нуклеиновых кислотах, защищается от изменений системами репарации и мультиплицируется при помощи репликации ДНК.
Некоторые вирусы имеют РНК-содержащий геном. Например, вирус иммунодефицита человека использует обратную транскрипцию для создания матрицы ДНК из собственного РНК-содержащего генома[14]. Некоторые молекулы РНК обладают каталитическими свойствами (рибозимы) и входят в состав сплайсосом и рибосом.
Нуклеозиды — продукты присоединения азотистых оснований к сахару рибозе. Примерами азотистых оснований являются гетероциклические азотсодержащие соединения — производные пуринов и пиримидинов. Некоторые нуклеотиды также выступают в качестве коферментов в реакциях переноса функциональных групп[15].
![]()
![]() Коферменты
Коферменты![]() Править
Править
Метаболизм включает широкий спектр химических реакций, большинство из которых относится к нескольким основным типам реакций переноса функциональных групп[16]. Для переноса функциональных групп между ферментами, катализирующими химические реакции, используются коферменты[15]. Каждый класс химических реакций переноса функциональных групп катализируется отдельными ферментами и их кофакторами[17].
Аденозинтрифосфат (АТФ) — один из центральных коферментов, универсальный источник энергии клеток. Этот нуклеотид используется для передачи химической энергии, запасённой в макроэргических связях, между различными химическими реакциями. В клетках существует небольшое количество АТФ, который постоянно регенерируется из AДФ и AМФ. Организм человека за сутки расходует массу АТФ, равную массе собственного тела[17]. АТФ выступает в качестве связующего звена между катаболизмом и анаболизмом: при катаболических реакциях образуется АТФ, при анаболических — энергия потребляется. АТФ также выступает донором фосфатной группы в реакциях фосфорилирования.
Витамины — низкомолекулярные органические вещества, необходимые в небольших количествах, причём, например, у человека большинство витаминов не синтезируется, а получается с пищей или через микрофлору ЖКТ. В организме человека большинство витаминов являются кофакторами ферментов. Большинство витаминов приобретает биологическую активность в изменённом виде, например, все водорастворимые витамины в клетках фосфорилируются или соединяются с нуклеотидами[18]. Никотинамидадениндинуклеотид (NADH) является производным витамина B3 (ниацина) и представляет собой важный кофермент — акцептора водорода. Сотни различных ферментов дегидрогеназ отнимают электроны из молекул субстратов и переносят их на молекулы NAD+, восстанавливая его до NADH. Окисленная форма кофермента является субстратом для различных редуктаз в клетке[19]. NAD в клетке существует в двух связанных формах — NADH и NADPH. NAD+/NADH больше важен для протекания катаболических реакций, а NADP+/NADPH чаще используется в анаболических реакциях.

![]()
![]() Неорганические вещества и кофакторы
Неорганические вещества и кофакторы![]() Править
Править
Неорганические элементы играют важнейшую роль в обмене веществ. Около 99 % массы млекопитающего состоит из углерода, азота, кальция, натрия, магния, хлора, калия, водорода, фосфора, кислорода и серы[20]. Биологически значимые органические соединения (белки, жиры, углеводы и нуклеиновые кислоты) содержат большое количество углерода, водорода, кислорода, азота и фосфора[20].
Многие неорганические соединения являются ионными электролитами. Наиболее важны для организма ионы натрия, калия, кальция, магния, хлоридов, фосфатов и гидрокарбонатов. Баланс этих ионов внутри клетки и во внеклеточной среде определяет осмотическое давление и pH[21]. Концентрации ионов также играют важную роль для функционирования нервных и мышечных клеток. Потенциал действия в возбудимых тканях возникает при обмене ионами между внеклеточной жидкостью и цитоплазмой[22]. Электролиты входят и выходят из клетки через ионные каналы в плазматической мембране. Например, в ходе мышечного сокращения в плазматической мембране, цитоплазме и Т-трубочках перемещаются ионы кальция, натрия и калия[23].
Переходные металлы в организме являются микроэлементами, наиболее распространены цинк и железо[24][25]. Эти металлы используются некоторыми белками (например ферментами в качестве кофакторов) и имеют важное значение для регуляции активности ферментов и транспортных белков[26]. Кофакторы ферментов обычно прочно связаны со специфическим белком, однако могут модифицироваться в процессе катализа, при этом после окончания катализа всегда возвращаются к своему первоначальному состоянию (не расходуются). Металлы-микроэлементы усваиваются организмом при помощи специальных транспортных белков и не встречаются в организме в свободном состоянии, так как связаны со специфическими белками-переносчиками (например ферритином или металлотионеинами)[27][28].
![]()
![]() Классификация организмов по типу метаболизма
Классификация организмов по типу метаболизма![]() Править
Править
Все живые организмы можно разделить на восемь основных групп в зависимости от используемого: источника энергии, источника углерода и донора электронов (окисляемого субстрата)[29].
- В качестве источника энергии живые организмы могут использовать: энергию света (фото-) или энергию химических связей (хемо-). Дополнительно для описания паразитических организмов, использующих энергетические ресурсы хозяйской клетки, применяют термин паратроф.
- Помимо источника энергии живым организмам также требуется донор электронов, окисляемое вещество от которого отрывается электрон, который используется для синтеза органики. В качестве донора электронов (восстановителя) живые организмы могут использовать: неорганические вещества (лито-) или органические вещества (органо-).
- В качестве источника углерода живые организмы используют: углекислый газ (авто-) или органические вещества (гетеро-). Иногда термины авто- и гетеротроф используют в отношении других элементов, которые входят в состав биологических молекул в восстановленной форме (например азота, серы). В таком случае «автотрофными по азоту» организмами являются виды, использующие в качестве источника азота окисленные неорганические соединения (например растения; могут осуществлять восстановление нитратов). А «гетеротрофными по азоту» являются организмы, не способные осуществлять восстановление окисленных форм азота и использующие в качестве его источника органические соединения (например животные, для которых источником азота служат аминокислоты).
Название типа метаболизма формируется путём сложения соответствующих корней и добавлением в конце корня -троф-. В таблице представлены возможные типы метаболизма с примерами[30]:
| Источник энергии |
Донор электронов | Источник углерода | Тип метаболизма | Примеры |
|---|---|---|---|---|
| Солнечный свет Фото- |
Органические вещества -органо- |
Органические вещества -гетеротроф |
Пурпурные несерные бактерии, Галобактерии, Некоторые цианобактерии. | |
| Неорганический углерод** -автотроф |
Редкий тип метаболизма, связанный с окислением неусваиваемых веществ. Характерен для некоторых пурпурных бактерий. | |||
| Неорганические вещества -лито-* |
Органические вещества -гетеротроф |
Некоторые цианобактерии, пурпурные и зелёные бактерии, также гелиобактерии. | ||
| Неорганический углерод** -автотроф |
Высшие растения, Водоросли, Цианобактерии, Пурпурные серные бактерии, Зелёные бактерии. | |||
| Энергия химических связей Хемо- |
Органические вещества -органо- |
Органические вещества -гетеротроф |
Животные, Грибы, Большинство микроорганизмов редуцентов. | |
| Неорганический углерод** -автотроф |
Бактерии специализирующиеся на окислении трудноусваиваемых веществ, например факультативные метилотрофы, окисляющие муравьиную кислоту. | |||
| Неорганические вещества -лито-* |
Органические вещества -гетеротроф |
Метанобразующие археи, Водородные бактерии. | ||
| Неорганический углерод** -автотроф |
Железобактерии, Водородные бактерии, Нитрифицирующие бактерии, Серобактерии. |
- Некоторые авторы используют -гидро-, когда в качестве донора электронов выступает вода
- CO2, CO, HCHO, CH3OH, CH4 HCOO- и «неорганическая» метильная группа -СH3, присоединённая через атом кислорода, азота или серы к другим метильным группам (от одной до трёх) или к многоуглеродному скелету[31].
Классификация была разработана группой авторов (А. Львов, К. ван Ниль, F. J. Ryan, Э. Тейтем) и утверждена на 11-м симпозиуме в лаборатории Колд-Спринг-Харбор и изначально служила для описания типов питания микроорганизмов. Однако в настоящее время применяется и для описания метаболизма других организмов[32].
Из таблицы очевидно, что метаболические возможности прокариот значительно разнообразнее по сравнению с эукариотами, которые характеризуются фотолитоавтотрофным и хемоорганогетеротрофным типом метаболизма.
Следует отметить, что некоторые виды микроорганизмов могут в зависимости от условий среды (освещение, доступность органических веществ и т. д.) и физиологического состояния осуществлять метаболизм разного типа. Такое сочетание нескольких типов метаболизма описывается как миксотрофия.
При применении данной классификации к многоклеточным организмам важно понимать, что в рамках одного организма могут быть клетки, отличающиеся типом обмена веществ. Так клетки надземных, фотосинтезирующих органов многоклеточных растений характеризуются фотолитоавтотрофным типом метаболизма, в то время как клетки подземных органов описываются как хемоорганогетеротрофные. Так же как и в случае с микроорганизмами, при изменении условий среды, стадии развития и физиологического состояния тип метаболизма клеток многоклеточного организма может изменяться. Так, например, в темноте и на стадии прорастания семени клетки высших растений осуществляют метаболизм хемоорганогетеротрофного типа.
![]()
![]() Катаболизм
Катаболизм![]() Править
Править
Катаболизмом называют метаболические процессы, при которых расщепляются относительно крупные органические молекулы сахаров, жиров, аминокислот. В ходе катаболизма образуются более простые органические молекулы, необходимые для реакций анаболизма (биосинтеза). Часто именно в ходе реакций катаболизма организм мобилизует энергию, переводя энергию химических связей органических молекул, полученных в процессе переваривания пищи, в доступные формы: в виде АТФ, восстановленных коферментов и трансмембранного электрохимического потенциала. Термин катаболизм не является синонимом «энергетического обмена»: у многих организмов (например у фототрофов) основные процессы запасания энергии не связаны напрямую с расщеплением органических молекул. Классификация организмов по типу метаболизма может быть основана на источнике получения энергии, что отражено в предыдущем разделе. Энергию химических связей используют хемотрофы, а фототрофы потребляют энергию солнечного света. Однако все эти различные формы обмена веществ зависят от окислительно-восстановительных реакций, которые связаны с передачей электронов от восстановленных доноров молекул, таких как органические молекулы, вода, аммиак, сероводород, на акцепторные молекулы, такие как кислород, нитраты или сульфат[33]. У животных эти реакции сопряжены с расщеплением сложных органических молекул до более простых, таких как двуокись углерода и воду. В фотосинтезирующих организмах — растениях и цианобактериях — реакции переноса электрона не высвобождают энергию, но они используются как способ запасания энергии, поглощаемой из солнечного света[34].
Катаболизм у животных может быть разделён на три основных этапа. Во-первых, крупные органические молекулы, такие как белки, полисахариды и липиды, расщепляются до более мелких компонентов вне клеток. Далее эти небольшие молекулы попадают в клетки и превращается в ещё более мелкие молекулы, например ацетил-КоА. В свою очередь, ацетильная группа кофермента А окисляется до воды и углекислого газа в цикле Кребса и дыхательной цепи, высвобождая при этом энергию, которая запасается в форме АТР.
![]()
![]() Пищеварение
Пищеварение![]() Править
Править
Такие макромолекулы, как крахмал, целлюлоза или белки, должны расщепляться до более мелких единиц прежде, чем они могут быть использованы клетками. Несколько классов ферментов принимают участие в деградации: протеазы, которые расщепляют белки до пептидов и аминокислот, гликозидазы, которые расщепляют полисахариды до олиго- и моносахаридов.
Микроорганизмы выделяют гидролитические ферменты в пространство вокруг себя[35][36], чем отличаются от животных, которые выделяют такие ферменты только из специализированных железистых клеток[37]. Аминокислоты и моносахариды, образующиеся в результате активности внеклеточных ферментов, затем поступают в клетки с помощью активного транспорта[38][39].
![]()
![]() Получение энергии
Получение энергии![]() Править
Править
В ходе катаболизма углеводов сложные сахара расщепляются до моносахаридов, которые усваиваются клетками[40]. Попав внутрь, сахара (например глюкоза и фруктоза) в процессе гликолиза превращаются в пируват, при этом вырабатывается некоторое количество АТФ[41]. Пировиноградная кислота (пируват) является промежуточным продуктом в нескольких метаболических путях. Основной путь метаболизма пирувата — превращение в ацетил-КоА и далее поступление в цикл трикарбоновых кислот. При этом в цикле Кребса в форме АТР запасается часть энергии, а также восстанавливаются молекулы NADH и FAD. В процессе гликолиза и цикла трикарбоновых кислот образуется диоксид углерода, который является побочным продуктом жизнедеятельности. В анаэробных условиях в результате гликолиза из пирувата при участии фермента лактатдегидрогеназы образуется лактат и происходит окисление NADH до NAD+, который повторно используется в реакциях гликолиза. Существует также альтернативный путь метаболизма моносахаридов — пентозофосфатный путь, в ходе реакций которого энергия запасается в форме восстановленного кофермента NADPH и образуются пентозы, например рибоза, необходимая для синтеза нуклеиновых кислот.
Жиры на первом этапе катаболизма гидролизуются в свободные жирные кислоты и глицерин. Жирные кислоты расщепляются в процессе бета-окисления с образованием ацетил-КоА, который в свою очередь далее катаболизируется в цикле Кребса, либо идёт на синтез новых жирных кислот. Жирные кислоты выделяют больше энергии, чем углеводы, так как жиры содержат удельно больше атомов водорода в своей структуре.
Аминокислоты либо используются для синтеза белков и других биомолекул, либо окисляются до мочевины, диоксида углерода и служат источником энергии[42]. Окислительный путь катаболизма аминокислот начинается с удаления аминогруппы ферментами трансаминазами. Аминогруппы утилизируются в цикле мочевины; аминокислоты, лишённые аминогрупп, называют кетокислотами. Некоторые кетокислоты — промежуточные продукты цикла Кребса. Например, при дезаминировании глутамата образуется альфа-кетоглутаровая кислота[43]. Гликогенные аминокислоты также могут быть преобразованы в глюкозу в реакциях глюконеогенеза[44].
![]()
![]() Энергетические превращения
Энергетические превращения![]() Править
Править
![]()
![]() Окислительное фосфорилирование
Окислительное фосфорилирование![]() Править
Править
При окислительном фосфорилировании электроны, удалённые из пищевых молекул в метаболических путях (например в цикле Кребса), переносятся на кислород, а выделяющаяся энергия используется для синтеза АТФ. У эукариот данный процесс осуществляется при участии ряда белков, закреплённых в мембранах митохондрий, называемых дыхательной цепью переноса электронов. У прокариот эти белки присутствуют во внутренней мембране клеточной стенки[45]. Белки цепи переноса электронов используют энергию, полученную при передаче электронов от восстановленных молекул (например NADH) на кислород, для перекачки протонов через мембрану[46].
При перекачке протонов создаётся разница концентраций ионов водорода и возникает электрохимический градиент[47]. Эта сила возвращает протоны обратно в митохондрии через основание АТФ-синтазы. Поток протонов заставляет вращаться кольцо из c-субъединиц фермента, в результате чего активный центр синтазы изменяет форму и фосфорилирует аденозиндифосфат, превращая его в АТФ[17].
![]()
![]() Энергия из неорганических соединений
Энергия из неорганических соединений![]() Править
Править
Хемолитотрофами называют прокариот, имеющих особый тип обмена веществ, при котором энергия образуется в результате окисления неорганических соединений. Хемолитотрофы могут окислять молекулярный водород[48], соединения серы (например сульфиды, сероводород и неорганические тиосульфаты)[1], оксид железа(II)[49] или аммиак[50]. При этом энергия от окисления этих соединений образуется с помощью акцепторов электронов, таких как кислород или нитриты[51]. Процессы получения энергии из неорганических веществ играют важную роль в таких биогеохимических циклах, как ацетогенез, нитрификация и денитрификация[52][53].
![]()
![]() Энергия из солнечного света
Энергия из солнечного света![]() Править
Править
Энергия солнечного света поглощается растениями, цианобактериями, пурпурными бактериями, зелёными серными бактериями и некоторыми простейшими. Этот процесс часто сочетается с превращением диоксида углерода в органические соединения, как часть процесса фотосинтеза (см. ниже). Системы захвата энергии и фиксации углерода у некоторых прокариот могут работать раздельно (например у пурпурных и зелёных серных бактерий)[54][55].
У многих организмов поглощение солнечной энергии в принципе аналогично окислительному фосфорилированию, так как при этом энергия запасается в форме градиента концентрации протонов и движущая сила протонов приводит к синтезу АТФ[17]. Электроны, необходимые для этой цепи переноса, поступают от светособирающих белков, называемых центрами фотосинтетических реакций (примером являются родопсины). В зависимости от вида фотосинтетических пигментов классифицируют два типа центров реакций; в настоящее время большинство фотосинтезирующих бактерий имеют только один тип, в то время как растения и цианобактерии два[56].
У растений, водорослей и цианобактерий фотосистема II использует энергию света для удаления электронов из воды, при этом молекулярный кислород выделяется как побочный продукт реакции. Электроны затем поступают в комплекс цитохрома b6f, который использует энергию для перекачки протонов через тилакоидную мембрану в хлоропластах[7]. Под действием электрохимического градиента протоны движутся обратно через мембрану и запускают АТР-синтазу. Электроны затем проходят через фотосистему I и могут быть использованы для восстановления кофермента NADP+, для использования в цикле Кальвина или рециркуляции для образования дополнительных молекул АТР[57].
![]()
![]() Анаболизм
Анаболизм![]() Править
Править
Анаболизм — совокупность метаболических процессов биосинтеза сложных молекул с затратой энергии. Сложные молекулы, входящие в состав клеточных структур, синтезируются последовательно из более простых предшественников. Анаболизм включает три основных этапа, каждый из которых катализируется специализированным ферментом. На первом этапе синтезируются молекулы-предшественники, например аминокислоты, моносахариды, терпеноиды и нуклеотиды. На втором этапе предшественники с затратой энергии АТФ преобразуются в активированные формы. На третьем этапе активированные мономеры объединяются в более сложные молекулы, например белки, полисахариды, липиды и нуклеиновые кислоты.
Не все живые организмы могут синтезировать все биологически активные молекулы. Автотрофы (например растения) могут синтезировать сложные органические молекулы из таких простых неорганических низкомолекулярных веществ, как углекислый газ и вода. Гетеротрофам необходим источник более сложных веществ, таких как моносахариды и аминокислоты, для создания более сложных молекул. Организмы классифицируют по их основным источникам энергии: фотоавтотрофы и фотогетеротрофы получают энергию из солнечного света, в то время как хемоавтотрофы и хемогетеротрофы получают энергию из неорганических реакций окисления.
![]()
![]() Связывание углерода
Связывание углерода![]() Править
Править

Фотосинтезом называют процесс биосинтеза сахаров из углекислого газа, при котором необходимая энергия поглощается из солнечного света. У растений, цианобактерий и водорослей при кислородном фотосинтезе происходит фотолиз воды, при этом как побочный продукт выделяется кислород. Для преобразования CO2 в 3-фосфоглицерат используется энергия АТФ и НАДФ, запасённая в фотосистемах. Реакция связывания углерода осуществляется с помощью фермента рибулозобисфосфаткарбоксилазы и является частью цикла Кальвина[58]. У растений классифицируют три типа фотосинтеза — по пути трёхуглеродых молекул, по пути четырёхуглеродых молекул (С4), и CAM фотосинтез. Три типа фотосинтеза отличаются по пути связывания углекислого газа и его вхождения в цикл Кальвина; у C3 растений связывание CO2 происходит непосредственно в цикле Кальвина, а при С4 и CAM CO2 предварительно включается в состав других соединений. Разные формы фотосинтеза являются приспособлениями к интенсивному потоку солнечных лучей и к сухим условиям[59].
У фотосинтезирующих прокариот механизмы связывания углерода более разнообразны. Углекислый газ может быть фиксирован в цикле Кальвина, в обратном цикле Кребса[60] или в реакциях карбоксилирования ацетил-КоА[61][62]. Прокариоты — хемоавтотрофы также связывают CO2 через цикл Кальвина, но для протекания реакции используют энергию из неорганических соединений[63].
![]()
![]() Углеводы и гликаны
Углеводы и гликаны![]() Править
Править
В процессе анаболизма сахаров простые органические кислоты могут быть преобразованы в моносахариды, например в глюкозу, и затем использованы для синтеза полисахаридов, таких как крахмал. Образование глюкозы из соединений, таких как пируват, лактат, глицерин, 3-фосфоглицерат и аминокислот, называют глюконеогенезом. В процессе глюконеогенеза пируват превращается в глюкозо-6-фосфат через ряд промежуточных соединений, многие из которых образуются и при гликолизе[41]. Однако глюконеогенез не просто является гликолизом в обратном направлении, так как несколько химических реакций катализируют специальные ферменты, что даёт возможность независимо регулировать процессы образования и распада глюкозы[64][65].
Многие организмы запасают питательные вещества в форме липидов и жиров, однако позвоночные не имеют ферментов, катализирующих превращение ацетил-КоА (продукта метаболизма жирных кислот) в пируват (субстрат глюконеогенеза)[66]. После длительного голодания позвоночные начинают синтезировать кетоновые тела из жирных кислот, которые могут заменять глюкозу в таких тканях, как головной мозг[67]. У растений и бактерий данная метаболическая проблема решается использованием глиоксилатного цикла, который обходит этап декарбоксилирования в цикле лимонной кислоты и позволяет превращать ацетил-КоА в оксалоацетат и далее использовать для синтеза глюкозы[66][68]. Помимо жира, глюкоза хранится в большинстве тканей в качестве энергетического ресурса, доступного в тканях посредством гликогенеза, который обычно используется для поддержания уровня глюкозы в крови[69].
Полисахариды и гликаны образуются путем последовательного добавления моносахаридов гликозилтрансферазой из реактивного донора сахара-фосфата, такого как уридиндифосфат глюкозы (UDP-Glc), к акцепторной гидроксильной группе на растущем полисахариде. Поскольку любая из гидроксильных групп в кольце субстрата может быть акцепторами, полученные полисахариды могут иметь прямые или разветвленные структуры[70]. Полисахариды выполняют структурные и метаболические функции, а также могут быть соединены с липидами (гликолипиды) и белками (гликопротеиды) при помощи ферментов олигосахаридтрансфераз[71][72].
![]()
![]() Жирные кислоты, изопреноиды и стероиды
Жирные кислоты, изопреноиды и стероиды![]() Править
Править

Жирные кислоты образуются синтазами жирных кислот из ацетил-КоА. Углеродный скелет жирных кислот удлиняется в цикле реакций, в которых сначала присоединяется ацетильная группа, далее карбонильная группа восстанавливается до гидроксильной, затем происходит дегидратация и последующее восстановление. Ферменты биосинтеза жирных кислот классифицируют на две группы: у животных и грибов все реакции синтеза жирных кислот осуществляются одним многофункциональным белком I типа[73], в пластидах растений и у бактерий каждый этап катализируют отдельные ферменты II типа[74][75].
Терпены и терпеноиды являются представителями самого многочисленного класса растительных натуральных продуктов[76]. Представители данной группы веществ являются производными изопрена и образуются из активированных предшественников изопентилпирофосфата и диметилаллилпирофосфата, которые, в свою очередь, образуются в разных реакциях обмена веществ[77]. У животных и архей изопентилпирофосфат и диметилаллилпирофосфат синтезируются из ацетил-КоА в мевалонатном пути[78], в то время как у растений и бактерий субстратами не-мевалонатного пути являются пируват и глицеральдегид-3-фосфат[77][79]. В реакциях биосинтеза стероидов молекулы изопрена объединяются и образуют сквалены, которые далее формируют циклические структуры с образованием ланостерола[80]. Ланостерол может быть преобразован в другие стероиды, например холестерин и эргостерин[80][81].
![]()
![]() Белки
Белки![]() Править
Править
Организмы различаются по способности к синтезу 20 общих аминокислот. Большинство бактерий и растений могут синтезировать все 20, но млекопитающие способны синтезировать лишь 10 заменимых аминокислот[7]. Таким образом, в случае млекопитающих 9 незаменимых аминокислот должны быть получены из пищи. Некоторые простые паразиты, такие как бактерии Mycoplasma pneumoniae, не синтезируют все аминокислоты и получают их непосредственно от своих хозяев[82]. Все аминокислоты синтезируются из промежуточных продуктов гликолиза, цикла лимонной кислоты или пентозомонофосфатного пути. Перенос аминогрупп с аминокислот на альфа-кетокислоты называется трансаминированием. Донорами аминогрупп являются глутамат и глутамин[83]. Второстепенный синтез аминокислот зависит от образования соответствующей альфа-кетокислоты, которая затем подвергается трансаминированию с образованием аминокислоты[84].
Аминокислоты, соединёнными пептидными связями, образуют белки. Каждый белок имеет уникальную последовательность аминокислотных остатков (первичная структура белка). Подобно тому, как буквы алфавита могут комбинироваться с образованием почти бесконечных вариаций слов, аминокислоты могут связываться в той или иной последовательности и формировать разнообразные белки. Белки состоят из аминокислот, которые были активированы путем присоединения к молекуле переносной РНК через эфирную связь. Фермент Аминоацил-тРНК-синтетаза катализирует АТР-зависимое присоединение аминокислот к тРНК сложноэфирными связями, при этом образуются аминоацил-тРНК[85]. Аминоацил-тРНК являются субстратами для рибосом, которая объединяют аминокислоты в длинные полипептидные цепочки, используя матрицу мРНК[86].
![]()
![]() Нуклеотиды
Нуклеотиды![]() Править
Править
Нуклеотиды образуются из аминокислот, углекислого газа и муравьиной кислоты в цепи реакций, для протекания которых требуется большое количество энергии[87][88]. Именно поэтому большинство организмов имеют эффективные системы сохранения ранее синтезированных нуклеотидов и азотистых оснований[87][89]. Пурины синтезируются как нуклеозиды (в основном связанные с рибозой). Аденин и гуанин образуются из инозин-монофосфата, который синтезируется из глицина, глутамина и аспартата при участии метенил-тетрагидрофолата. Пиримидины синтезируются из оротата, который образуется из глутамина и аспартата[90].
![]()
![]() Ксенобиотики и окислительный метаболизм
Ксенобиотики и окислительный метаболизм![]() Править
Править
Все организмы постоянно подвергаются воздействию соединений, накопление которых может быть вредно для клеток. Такие потенциально опасные чужеродные соединения называются ксенобиотиками[91]. Ксенобиотики, например синтетические лекарства и яды природного происхождения, детоксифицируются специализированными ферментами. У человека такие ферменты представлены, например, цитохром-оксидазами[92], глюкуронилтрансферазой[93], и глутатион S-трансферазой[94]. Эта система ферментов действует в три этапа: на первой стадии ксенобиотики окисляются, затем происходит конъюгирование водорастворимых групп в молекулы, далее модифицированные водорастворимые ксенобиотики могут быть удалены из клеток и метаболизированы перед их экскрецией. Описанные реакции играют важную роль в разложении микробами загрязняющих веществ и биоремедиации загрязнённых земель и разливов нефти[95]. Многие подобные реакции протекают при участии многоклеточных организмов, однако, ввиду невероятного разнообразия, микроорганизмы справляются с гораздо более широким спектром ксенобиотиков, чем многоклеточные организмы, и способны даже разрушать стойкие органические загрязнители, например хлорорганические соединения[96].
Связанной с этим проблемой для аэробных организмов является оксидативный стресс[97]. В процессе окислительного фосфорилирования и образования дисульфидных связей при укладке белка образуются активные формы кислорода, например пероксид водорода[98]. Эти повреждающие оксиданты удаляются антиоксидантами, например глутатионом и ферментами каталазой и пероксидазами[99][100].
![]()
![]() Термодинамика живых организмов
Термодинамика живых организмов![]() Править
Править
Живые организмы подчиняются началам термодинамики, которые описывают превращения тепла и работы. Второе начало термодинамики гласит, что в любой изолированной системе энтропия не уменьшается. Хотя может показаться, что невероятная сложность живых организмов противоречит этому закону, жизнь возможна, так как все организмы являются открытыми системами, которые обмениваются веществом и энергией с окружающей средой. Таким образом, живые системы не находятся в термодинамическом равновесии, но, вместо этого, выступают диссипативной системой, которая поддерживает своё состояние сложной организованности, вызывая большее увеличение энтропии окружающей средой[101]. В метаболизме клеток это достигается путём сочетания спонтанных процессов катаболизма и неспонтанных процессов анаболизма. В термодинамических условиях метаболизм поддерживает порядок за счёт создания беспорядка[102].
![]()
![]() Регуляция и контроль
Регуляция и контроль![]() Править
Править
Гомеостазом называют постоянство внутренней среды организма. Так как внешняя среда, окружающая большинство организмов, постоянно меняется, для поддержания постоянных условий внутри клеток реакции обмена веществ должны точно регулироваться[103][104]. Регуляция метаболизма позволяет организмам отвечать на сигналы и активно взаимодействовать с окружающей средой[105]. В случае фермента регуляция заключается в повышении и снижении его активности в ответ на сигналы. С другой стороны, фермент оказывает некоторый контроль над метаболическим путём, который определяется как эффект от изменения активности фермента на данный метаболический путь[106].

Выделяют несколько уровней регуляции метаболизма. В метаболическом пути происходит саморегуляция на уровне субстрата или продукта; например, уменьшение количества продукта может компенсированно увеличить поток субстрата реакции по данному пути[107]. Этот тип регулирования часто включает аллостерическое регулирование активности некоторых ферментов в метаболических путях[108]. Внешний контроль включает клетку многоклеточного организма, изменяющую свой метаболизм в ответ на сигналы от других клеток. Эти сигналы, как правило, в виде растворимых мессенджеров, например гормоны и факторы роста, определяются специфическими рецепторами на поверхности клеток[109]. Затем эти сигналы передаются внутрь клетки системой вторичных мессенджеров, которые зачастую связаны с фосфорилированием белков[110].
Хорошо изученный пример внешнего контроля — регуляция метаболизма глюкозы инсулином[111]. Инсулин вырабатывается в ответ на повышение уровня глюкозы в крови. Гормон связывается с инсулиновым рецептором на поверхности клетки, затем активируется каскад протеинкиназ, которые обеспечивают поглощение молекул глюкозы клетками и преобразовывают их в молекулы жирных кислот и гликогена[112]. Метаболизм гликогена контролируется активностью фосфорилазы (фермента, который расщепляет гликоген) и гликогенсинтазы (фермента, который образует его). Эти ферменты взаимосвязаны; фосфорилирование ингибируется гликогенсинтазой, но активируется фосфорилазой. Инсулин вызывает синтез гликогена путём активации белковых фосфатаз и уменьшает фосфорилирование этих ферментов[113].
![]()
![]() Эволюция
Эволюция![]() Править
Править
Главные пути метаболизма, описанные выше, например гликолиза и цикла Кребса, присутствуют у всех трёх доменах живых существ и обнаруживаются у последнего универсального общего предка[3][114]. Этот универсальный предок был прокариотом и, вероятно, метаногеном с аминокислотным, нуклеотидным, углеводным метаболизмом[115][116]. Сохранение этих древних метаболических путей в эволюции может быть результатом того, что эти реакции оптимальны для решения конкретных проблем с метаболизмом. Так, конечные продукты гликолиза и цикла Кребса образуются с высокой эффективностью и с минимальным количеством стадий[4][5]. Первые метаболические пути на основе ферментов могли быть частями пуринового метаболизма нуклеотидов с предыдущим метаболических путей и были частью древнего мира РНК[117].
Многие модели были предложены для описания механизмов, посредством которых новые метаболические пути эволюционировали. К ним относятся последовательное добавление новых ферментов на короткий предковый путь, дупликация, а затем дивергенция всех путей, а также набор уже существующих ферментов и их сборка в новый путь реакций[118]. Относительная важность этих механизмов неясна, однако геномные исследования показали, что ферменты в метаболическом пути, скорее всего, имеют общее происхождение, если предполагать, что многие пути эволюционировали шаг за шагом с новыми функциями, созданными из уже существующих этапов пути[119]. Альтернативная модель основана на исследованиях, в которых прослеживается эволюция структуры белков в метаболических связях; предполагают, что ферменты собирались для выполнения схожих функций в различных метаболических путях[120]. Эти процессы сборки привели к эволюционированию ферментативной мозаики[121]. Некоторые части обмена веществ, возможно, существовали в качестве «модулей», которые могли быть повторно использованы в различных путях для выполнения схожих функций[122].
Эволюция также может приводить к потере метаболических функций. Например, у некоторых паразитов метаболические процессы, которые не важны для выживания, утрачены и готовые аминокислоты, нуклеотиды и углеводы получаются от хозяина[123]. Подобные упрощения метаболических возможностей наблюдают у эндосимбиотических организмов[124].
![]()
![]() Методы исследования
Методы исследования![]() Править
Править

Классически, метаболизм изучается упрощённым подходом, который фокусируется на одном метаболическом пути. Особенно ценно использование меченых атомов на организменном, тканевом и клеточном уровнях, которые определяют пути от предшественников до конечных продуктов путём выявления радиоактивно меченых промежуточных продуктов[125]. Ферменты, которые катализируют эти химические реакции, могут затем быть выделены для исследования их кинетики и ответа на ингибиторы. Параллельный подход заключается в выявлении небольших молекул в клетки или ткани; полный набор этих молекул называется метаболом. В целом, эти исследования дают хорошее представление о структуре и функциях простых путей метаболизма, но недостаточны в применении к более сложных системам, например полной метаболизм клетки[126].
Идея сложности метаболических сетей в клетках, которые содержат тысячи различных ферментов, отражена на изображении справа, показывающем взаимодействия только между 43 белками и 40 метаболитами, которые регулируются 45 000 генов[127]. Тем не менее сейчас можно использовать такие данные о геномах для воссоздания полной сети биохимических реакций и образовывать более целостные математические модели, которые могут объяснить и предсказать их поведение[128]. Эти модели особенно сильны, когда используются для интеграции данных о путях и метаболитах, полученных на основе классических методов, с данными по экспрессии генов из протеомных и ДНК-микрочиповых исследований[129]. С помощью этих методов в настоящее время создаётся модель человеческого метаболизма, которая будет служить ориентиром для будущих исследований лекарств и биохимических исследований[130]. Эти модели в настоящее время используются в анализах сети для классификации болезней человека по группам, которые различаются по общим белкам или метаболитам[131][132].
Яркий пример бактериальных метаболических сетей — устройство галстук-бабочки[133][134][135], структура которой позволяет вводить широкий спектр питательных веществ и производить большое разнообразие продуктов и сложных макромолекул, используя сравнительно немного общих промежуточных веществ.
Основная технологическая основа этой информации — метаболическая инженерия. Здесь организмы, например дрожжи, растения или бактерии, генетически модифицируются, чтобы сделать их более эффективными в биотехнологии и помочь в производстве лекарств, например антибиотиков или промышленных химических веществ, таких как 1,3-пропандиола и шикимовой кислоты[136]. Эти генетические модификации обычно направлены на уменьшение количества энергии, используемой для производства продукции, повышения урожайности и снижения производственных отходов[137].
![]()
![]() История
История![]() Править
Править

Термин «метаболизм» впервые введён был в биологию Теодором Шванном в 1840-х годах, однако не получил широкого использования. Термин устоялся в физиологии и проник в большинство языков после издания и перевода руководства по физиологии Фостера в 1870-х годах[138].
История изучения метаболизма охватывает несколько столетий. Исследования начинались с изучения организмов животных, в современной биохимии изучают отдельные метаболические реакции. Понятие обмена веществ впервые встречается в работах Ибн аль-Нафиса (1213—1288), который писал, что «тело и его части находятся в постоянном состоянии распада и питания, так что оно неизбежно претерпевает постоянные изменения»[139]. Первые контролируемые эксперименты по метаболизму у человека были опубликованы Санторио Санторио в 1614 году в книге итал. Ars de statica medicina[140]. Он рассказал, как он сам взвесил себя до и после приёма пищи, сна, работы, секса, натощак, после питья и выделения мочи. Он обнаружил, что большая часть пищи, которую он принял, была утрачена в результате процесса, названного «незаметным испарением».
В ранних исследованиях механизмы метаболических реакций не были обнаружены и считалось, что живой тканью управляет живая сила[141]. В XIX веке при исследовании ферментации сахара спирта дрожжами Луи Пастер сделал вывод, что брожение катализируется веществами из дрожжевых клеток, которые он назвал ферментами. Пастер писал, что «алкогольное брожение — действие, связанное с жизнью и организуется дрожжевыми клетками, не связано со смертью или разложением клеток»[142]. Это открытие, вместе с публикацией Фридриха Вёлера в 1828 году о химическом синтезе мочевины[143], доказало, что органические соединения и химические реакции, обнаруженные в клетках, не имеют различий в принципе, как и любые другие разделы химии.
Открытие ферментов в начале XX века Эдуардом Бухнером разделило изучение метаболических реакций от изучения клеток и дало начало развитию биохимии как науки[144]. Одним из успешных биохимиков начала двадцатого века был Ханс Адольф Кребс, который внёс огромный вклад в изучение метаболизма[145]. Кребс описал цикл мочевины и позднее, работая вместе с Хансом Корнбергом, цикл лимонной кислоты и глиоксилатный цикл[68][146]. В современных биохимических исследованиях широко используют новые методы, такие как хроматография, рентгеноструктурный анализ, ЯМР-спектроскопия, электронная микроскопия и метод классической молекулярной динамики. Эти методы позволяют открывать и подробно изучать множество молекул и метаболических путей в клетках.
![]()
![]() См. также
См. также![]() Править
Править
![]()
![]() Примечания
Примечания![]() Править
Править
↑ 1 2
Friedrich C. Physiology and genetics of sulfur-oxidizing bacteria (англ.) //
Advances in Microbial Physiology
(англ.)
(
рус. : journal. — Academic Press, 1998. —
Vol. 39. —
P. 235—289. — doi:10.1016/S0065-2911(08)60018-1. — PMID 9328649.
↑
Pace N. R. The universal nature of biochemistry (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2001. — January (
vol. 98,
no. 3). —
P. 805—808. — doi:10.1073/pnas.98.3.805. — PMID 11158550.
↑ 1 2
Smith E., Morowitz H. Universality in intermediary metabolism (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2004. —
Vol. 101,
no. 36. —
P. 13168—13173. — doi:10.1073/pnas.0404922101. — PMID 15340153.
↑ 1 2
Ebenhöh O., Heinrich R. Evolutionary optimization of metabolic pathways. Theoretical reconstruction of the stoichiometry of ATP and NADH producing systems (англ.) // Bull Math Biol : journal. — 2001. —
Vol. 63,
no. 1. —
P. 21—55. — doi:10.1006/bulm.2000.0197. — PMID 11146883.
↑ 1 2
Meléndez-Hevia E., Waddell T., Cascante M. The puzzle of the Krebs citric acid cycle: assembling the pieces of chemically feasible reactions, and opportunism in the design of metabolic pathways during evolution (англ.) //
J Mol Evol
(англ.)
(
рус. : journal. — 1996. —
Vol. 43,
no. 3. —
P. 293—303. — doi:10.1007/BF02338838. — PMID 8703096.
↑
Michie K., Löwe J. Dynamic filaments of the bacterial cytoskeleton (англ.) //
Annu Rev Biochem
(англ.)
(
рус. : journal. — 2006. —
Vol. 75. —
P. 467—492. — doi:10.1146/annurev.biochem.75.103004.142452. — PMID 16756499.
↑ 1 2 3 4 5 6
Nelson, David L.; Michael M. Cox. Lehninger Principles of Biochemistry (неопр.). — New York: W. H. Freeman and company, 2005. — С. 841. — ISBN 0-7167-4339-6.
↑
J. K. Kelleher, B. M. Bryan, R. T. Mallet, A. L. Holleran, A. N. Murphy. Analysis of tricarboxylic acid-cycle metabolism of hepatoma cells by comparison of 14CO2 ratios // The Biochemical Journal. — 1987-09-15. —
Т. 246,
вып. 3. —
С. 633–639. — ISSN 0264-6021. — doi:10.1042/bj2460633.
↑
John S. Hothersall, Aamir Ahmed. Metabolic fate of the increased yeast amino Acid uptake subsequent to catabolite derepression // Journal of Amino Acids. — 2013. —
Т. 2013. —
С. 461901. — ISSN 2090-0104. — doi:10.1155/2013/461901.
↑
Fahy E., Subramaniam S., Brown H., Glass C., Merrill A., Murphy R., Raetz C., Russell D., Seyama Y., Shaw W., Shimizu T., Spener F., van Meer G., VanNieuwenhze M., White S., Witztum J., Dennis E. A comprehensive classification system for lipids (англ.) //
J Lipid Res
(англ.)
(
рус. : journal. — 2005. —
Vol. 46,
no. 5. —
P. 839—861. — doi:10.1194/jlr.E400004-JLR200. — PMID 15722563.
↑
Nomenclature of Lipids (неопр.). IUPAC-IUB Commission on Biochemical Nomenclature (CBN). Дата обращения: 8 марта 2007. Архивировано 22 августа 2011 года.
↑
Hegardt F. Mitochondrial 3-hydroxy-3-methylglutaryl-CoA synthase: a control enzyme in ketogenesis (англ.) //
Biochem J
(англ.)
(
рус. : journal. — 1999. —
Vol. 338,
no. Pt 3. —
P. 569—582. — doi:10.1042/0264-6021:3380569. — PMID 10051425.
↑
Raman R., Raguram S., Venkataraman G., Paulson J., Sasisekharan R. Glycomics: an integrated systems approach to structure-function relationships of glycans (англ.) // Nat Methods : journal. — 2005. —
Vol. 2,
no. 11. —
P. 817—824. — doi:10.1038/nmeth807. — PMID 16278650.
↑
Sierra S., Kupfer B., Kaiser R. Basics of the virology of HIV-1 and its replication (англ.) // J Clin Virol : journal. — 2005. —
Vol. 34,
no. 4. —
P. 233—244. — doi:10.1016/j.jcv.2005.09.004. — PMID 16198625.
↑ 1 2
Wimmer M., Rose I. Mechanisms of enzyme-catalyzed group transfer reactions (англ.) //
Annu Rev Biochem
(англ.)
(
рус. : journal. — 1978. —
Vol. 47. —
P. 1031—1078. — doi:10.1146/annurev.bi.47.070178.005123. — PMID 354490.
↑
Mitchell P. The Ninth Sir Hans Krebs Lecture. Compartmentation and communication in living systems. Ligand conduction: a general catalytic principle in chemical, osmotic and chemiosmotic reaction systems (англ.) //
Eur J Biochem
(англ.)
(
рус. : journal. — 1979. —
Vol. 95,
no. 1. —
P. 1—20. — doi:10.1111/j.1432-1033.1979.tb12934.x. — PMID 378655.
↑ 1 2 3 4
Dimroth P., von Ballmoos C., Meier T. Catalytic and mechanical cycles in F-ATP synthases. Fourth in the Cycles Review Series (англ.) //
EMBO Rep
(англ.)
(
рус. : journal. — 2006. — March (
vol. 7,
no. 3). —
P. 276—282. — doi:10.1038/sj.embor.7400646. — PMID 16607397.
↑
Coulston, Ann; Kerner, John; Hattner, JoAnn; Srivastava, Ashini. Stanford School of Medicine Nutrition Courses (англ.). — SUMMIT, 2006.
↑
Pollak N., Dölle C., Ziegler M. The power to reduce: pyridine nucleotides—small molecules with a multitude of functions (англ.) //
Biochem J
(англ.)
(
рус. : journal. — 2007. —
Vol. 402,
no. 2. —
P. 205—218. — doi:10.1042/BJ20061638. — PMID 17295611.
↑ 1 2
Heymsfield S., Waki M., Kehayias J., Lichtman S., Dilmanian F., Kamen Y., Wang J., Pierson R. Chemical and elemental analysis of humans in vivo using improved body composition models (англ.) //
American Physiological Society
(англ.)
(
рус. : journal. — 1991. —
Vol. 261,
no. 2 Pt 1. —
P. E190—8. — PMID 1872381.
↑
Sychrová H. Yeast as a model organism to study transport and homeostasis of alkali metal cations (англ.) // Physiol Res : journal. — 2004. —
Vol. 53 Suppl 1. —
P. S91—8. — PMID 15119939.
↑
Levitan I. Modulation of ion channels in neurons and other cells (англ.) // Annu Rev Neurosci : journal. — 1988. —
Vol. 11. —
P. 119—136. — doi:10.1146/annurev.ne.11.030188.001003. — PMID 2452594.
↑
Dulhunty A. Excitation-contraction coupling from the 1950s into the new millennium (англ.) //
Clin Exp Pharmacol Physiol
(англ.)
(
рус. : journal. — 2006. —
Vol. 33,
no. 9. —
P. 763—772. — doi:10.1111/j.1440-1681.2006.04441.x. — PMID 16922804.
↑
Mahan D., Shields R. Macro- and micromineral composition of pigs from birth to 145 kilograms of body weight (англ.) //
J Anim Sci
(англ.)
(
рус. : journal. — 1998. —
Vol. 76,
no. 2. —
P. 506—512. — PMID 9498359. Архивировано 30 апреля 2011 года.
↑
Husted S., Mikkelsen B., Jensen J., Nielsen N. Elemental fingerprint analysis of barley (Hordeum vulgare) using inductively coupled plasma mass spectrometry, isotope-ratio mass spectrometry, and multivariate statistics (англ.) //
Anal Bioanal Chem
(англ.)
(
рус. : journal. — 2004. —
Vol. 378,
no. 1. —
P. 171—182. — doi:10.1007/s00216-003-2219-0. — PMID 14551660.
↑
Finney L., O'Halloran T. Transition metal speciation in the cell: insights from the chemistry of metal ion receptors (англ.) // Science : journal. — 2003. —
Vol. 300,
no. 5621. —
P. 931—936. — doi:10.1126/science.1085049. — PMID 12738850.
↑
Cousins R., Liuzzi J., Lichten L. Mammalian zinc transport, trafficking, and signals (англ.) // J Biol Chem : journal. — 2006. —
Vol. 281,
no. 34. —
P. 24085—24089. — doi:10.1074/jbc.R600011200. — PMID 16793761.
↑
Dunn L., Rahmanto Y., Richardson D. Iron uptake and metabolism in the new millennium (англ.) //
Trends Cell Biol
(англ.)
(
рус. : journal. — 2007. —
Vol. 17,
no. 2. —
P. 93—100. — doi:10.1016/j.tcb.2006.12.003. — PMID 17194590.
↑
Микробиология: учебник для студ. высш. учеб. заведений / А. И. Нетрусов, И. Б. Котова — М.: Издательский центр «Академия», 2006. — 352 с. ISBN 5-7695-2583-5
↑
Микробиология: учебник для студ. биол. специальностей вузов / М. В. Гусев, Л. А. Минеева — 4-е изд., стер. — М.: Издательский центр «Академия», 2003. — 464 с. ISBN 5-7695-1403-5
↑
Пиневич А.В. Микробиология. Биология прокариотов: Учебник. В 3 т. Том 2.. — СПб.: Изд-во С.-Петерб. ун-та, 2007. — 331 с. с. — ISBN ISBN 978-5-288-04269-0 (т.II)ISBN 5-288-04056-7.
↑
A. Lwoff, C. B. van Neil, F. J. Ryan et al. Nomenclature of nutritional types of microorganisms. — 1946. Архивировано 7 ноября 2017 года.
↑
Nealson K., Conrad P. Life: past, present and future (англ.) // Philos Trans R Soc Lond B Biol Sci : journal. — 1999. —
Vol. 354,
no. 1392. —
P. 1923—1939. — doi:10.1098/rstb.1999.0532. — PMID 10670014.
↑
Nelson N., Ben-Shem A. The complex architecture of oxygenic photosynthesis (англ.) // Nat Rev Mol Cell Biol : journal. — 2004. —
Vol. 5,
no. 12. —
P. 971—982. — doi:10.1038/nrm1525. — PMID 15573135.
↑
Häse C., Finkelstein R. Bacterial extracellular zinc-containing metalloproteases (рум.) //
Microbiology and Molecular Biology Reviews
(англ.)
(
рус.. —
American Society for Microbiology
(англ.)
(
рус., 1993. — Decembrie (
т. 57,
nr. 4). —
P. 823—837. — PMID 8302217.
↑
Gupta R., Gupta N., Rathi P. Bacterial lipases: an overview of production, purification and biochemical properties (англ.) //
Applied Microbiology and Biotechnology
(англ.)
(
рус. : journal. — Springer, 2004. —
Vol. 64,
no. 6. —
P. 763—781. — doi:10.1007/s00253-004-1568-8. — PMID 14966663.
↑
Hoyle T. The digestive system: linking theory and practice (неопр.) // Br J Nurs. — 1997. —
Т. 6,
№ 22. —
С. 1285—1291. — PMID 9470654.
↑
Souba W., Pacitti A. How amino acids get into cells: mechanisms, models, menus, and mediators (англ.) // JPEN J Parenter Enteral Nutr : journal. — 1992. —
Vol. 16,
no. 6. —
P. 569—578. — doi:10.1177/0148607192016006569. — PMID 1494216.
↑
Barrett M., Walmsley A., Gould G. Structure and function of facilitative sugar transporters (англ.) //
Curr Opin Cell Biol
(англ.)
(
рус. : journal. — Elsevier, 1999. —
Vol. 11,
no. 4. —
P. 496—502. — doi:10.1016/S0955-0674(99)80072-6. — PMID 10449337.
↑
Bell G., Burant C., Takeda J., Gould G. Structure and function of mammalian facilitative sugar transporters (англ.) // J Biol Chem : journal. — 1993. —
Vol. 268,
no. 26. —
P. 19161—19164. — PMID 8366068.
↑ 1 2
Bouché C., Serdy S., Kahn C., Goldfine A. The cellular fate of glucose and its relevance in type 2 diabetes (англ.) //
Endocrine Reviews
(англ.)
(
рус. : journal. —
Endocrine Society
(англ.)
(
рус., 2004. —
Vol. 25,
no. 5. —
P. 807—830. — doi:10.1210/er.2003-0026. — PMID 15466941. Архивировано 4 декабря 2012 года.
↑
Sakami W., Harrington H. Amino acid metabolism (англ.) //
Annu Rev Biochem
(англ.)
(
рус. : journal. — 1963. —
Vol. 32. —
P. 355—398. — doi:10.1146/annurev.bi.32.070163.002035. — PMID 14144484.
↑
Brosnan J. Glutamate, at the interface between amino acid and carbohydrate metabolism (англ.) //
J Nutr
(англ.)
(
рус. : journal. — 2000. —
Vol. 130,
no. 4S Suppl. —
P. 988S—90S. — PMID 10736367.
↑
Young V., Ajami A. Glutamine: the emperor or his clothes? (англ.) //
J Nutr
(англ.)
(
рус. : journal. — 2001. —
Vol. 131,
no. 9 Suppl. —
P. 2449S—59S; discussion 2486S—7S. — PMID 11533293.
↑
Hosler J., Ferguson-Miller S., Mills D. Energy transduction: proton transfer through the respiratory complexes (англ.) //
Annu Rev Biochem
(англ.)
(
рус. : journal. — 2006. —
Vol. 75. —
P. 165—187. — doi:10.1146/annurev.biochem.75.062003.101730. — PMID 16756489.
↑
Schultz B., Chan S. Structures and proton-pumping strategies of mitochondrial respiratory enzymes (англ.) // Annu Rev Biophys Biomol Struct : journal. — 2001. —
Vol. 30. —
P. 23—65. — doi:10.1146/annurev.biophys.30.1.23. — PMID 11340051.
↑
Capaldi R., Aggeler R. Mechanism of the F(1)F(0)-type ATP synthase, a biological rotary motor (англ.) //
Trends Biochem Sci
(англ.)
(
рус. : journal. — 2002. —
Vol. 27,
no. 3. —
P. 154—160. — doi:10.1016/S0968-0004(01)02051-5. — PMID 11893513.
↑
Friedrich B., Schwartz E. Molecular biology of hydrogen utilization in aerobic chemolithotrophs (англ.) // Annu Rev Microbiol : journal. — 1993. —
Vol. 47. —
P. 351—383. — doi:10.1146/annurev.mi.47.100193.002031. — PMID 8257102.
↑
Weber K., Achenbach L., Coates J. Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction (англ.) // Nat Rev Microbiol : journal. — 2006. —
Vol. 4,
no. 10. —
P. 752—764. — doi:10.1038/nrmicro1490. — PMID 16980937.
↑
Jetten M., Strous M., van de Pas-Schoonen K., Schalk J., van Dongen U., van de Graaf A., Logemann S., Muyzer G., van Loosdrecht M., Kuenen J. The anaerobic oxidation of ammonium (неопр.) // FEMS Microbiol Rev. — 1998. —
Т. 22,
№ 5. —
С. 421—437. — doi:10.1111/j.1574-6976.1998.tb00379.x. — PMID 9990725.
↑
Simon J. Enzymology and bioenergetics of respiratory nitrite ammonification (англ.) // FEMS Microbiol Rev : journal. — 2002. —
Vol. 26,
no. 3. —
P. 285—309. — doi:10.1111/j.1574-6976.2002.tb00616.x. — PMID 12165429.
↑
Conrad R. Soil microorganisms as controllers of atmospheric trace gases (H2, CO, CH4, OCS, N2O, and NO) (англ.) //
Microbiology and Molecular Biology Reviews
(англ.)
(
рус. : journal. —
American Society for Microbiology
(англ.)
(
рус., 1996. —
Vol. 60,
no. 4. —
P. 609—640. — PMID 8987358.
↑
Barea J., Pozo M., Azcón R., Azcón-Aguilar C. Microbial co-operation in the rhizosphere (англ.) // Journal of Experimental Botany : journal. — Oxford University Press, 2005. —
Vol. 56,
no. 417. —
P. 1761—1778. — doi:10.1093/jxb/eri197. — PMID 15911555.
↑
van der Meer M., Schouten S., Bateson M., Nübel U., Wieland A., Kühl M., de Leeuw J., Sinninghe Damsté J., Ward D. Diel variations in carbon metabolism by green nonsulfur-like bacteria in alkaline siliceous hot spring microbial mats from Yellowstone National Park (англ.) //
Appl Environ Microbiol
(англ.)
(
рус. : journal. — 2005. — July (
vol. 71,
no. 7). —
P. 3978—3986. — doi:10.1128/AEM.71.7.3978-3986.2005. — PMID 16000812.
↑
Tichi M., Tabita F. Interactive control of Rhodobacter capsulatus redox-balancing systems during phototrophic metabolism (англ.) //
American Society for Microbiology
(англ.)
(
рус. : journal. — 2001. —
Vol. 183,
no. 21. —
P. 6344—6354. — doi:10.1128/JB.183.21.6344-6354.2001. — PMID 11591679.
↑
Allen J., Williams J. Photosynthetic reaction centers (англ.) //
FEBS Lett
(англ.)
(
рус. : journal. — 1998. —
Vol. 438,
no. 1—2. —
P. 5—9. — doi:10.1016/S0014-5793(98)01245-9. — PMID 9821949.
↑
Munekage Y., Hashimoto M., Miyake C., Tomizawa K., Endo T., Tasaka M., Shikanai T. Cyclic electron flow around photosystem I is essential for photosynthesis (англ.) // Nature : journal. — 2004. —
Vol. 429,
no. 6991. —
P. 579—582. — doi:10.1038/nature02598. — PMID 15175756.
↑
Miziorko H., Lorimer G. Ribulose-1,5-bisphosphate carboxylase-oxygenase (англ.) //
Annu Rev Biochem
(англ.)
(
рус. : journal. — 1983. —
Vol. 52. —
P. 507—535. — doi:10.1146/annurev.bi.52.070183.002451. — PMID 6351728.
↑
Dodd A., Borland A., Haslam R., Griffiths H., Maxwell K. Crassulacean acid metabolism: plastic, fantastic (англ.) // Journal of Experimental Botany : journal. — Oxford University Press, 2002. —
Vol. 53,
no. 369. —
P. 569—580. — doi:10.1093/jexbot/53.369.569. — PMID 11886877.
↑
Hügler M., Wirsen C., Fuchs G., Taylor C., Sievert S. Evidence for autotrophic CO2 fixation via the reductive tricarboxylic acid cycle by members of the epsilon subdivision of proteobacteria (англ.) //
American Society for Microbiology
(англ.)
(
рус. : journal. — 2005. — May (
vol. 187,
no. 9). —
P. 3020—3027. — doi:10.1128/JB.187.9.3020-3027.2005. — PMID 15838028.
↑
Strauss G., Fuchs G. Enzymes of a novel autotrophic CO2 fixation pathway in the phototrophic bacterium Chloroflexus aurantiacus, the 3-hydroxypropionate cycle (англ.) //
Eur J Biochem
(англ.)
(
рус. : journal. — 1993. —
Vol. 215,
no. 3. —
P. 633—643. — doi:10.1111/j.1432-1033.1993.tb18074.x. — PMID 8354269.
↑
Wood H. Life with CO or CO2 and H2 as a source of carbon and energy (англ.) //
The FASEB Journal
(англ.)
(
рус. : journal. —
Federation of American Societies for Experimental Biology
(англ.)
(
рус., 1991. —
Vol. 5,
no. 2. —
P. 156—163. — PMID 1900793.
↑
Shively J., van Keulen G., Meijer W. Something from almost nothing: carbon dioxide fixation in chemoautotrophs (англ.) // Annu Rev Microbiol : journal. — 1998. —
Vol. 52. —
P. 191—230. — doi:10.1146/annurev.micro.52.1.191. — PMID 9891798.
↑
Boiteux A., Hess B. Design of glycolysis (англ.) // Philos Trans R Soc Lond B Biol Sci : journal. — 1981. —
Vol. 293,
no. 1063. —
P. 5—22. — doi:10.1098/rstb.1981.0056. — PMID 6115423.
↑
Pilkis S., el-Maghrabi M., Claus T. Fructose-2,6-bisphosphate in control of hepatic gluconeogenesis. From metabolites to molecular genetics (англ.) //
Diabetes Care
(англ.)
(
рус. : journal. — 1990. —
Vol. 13,
no. 6. —
P. 582—599. — doi:10.2337/diacare.13.6.582. — PMID 2162755.
↑ 1 2
Ensign S. Revisiting the glyoxylate cycle: alternate pathways for microbial acetate assimilation (англ.) //
Microbiology
(англ.)
(
рус. : journal. —
Microbiology Society
(англ.)
(
рус., 2006. —
Vol. 61,
no. 2. —
P. 274—276. — doi:10.1111/j.1365-2958.2006.05247.x. — PMID 16856935.
↑
Finn P., Dice J. Proteolytic and lipolytic responses to starvation (неопр.) // Nutrition. — 2006. —
Т. 22,
№ 7—8. —
С. 830—844. — doi:10.1016/j.nut.2006.04.008. — PMID 16815497.
↑ 1 2
Kornberg H., Krebs H. Synthesis of cell constituents from C2-units by a modified tricarboxylic acid cycle (англ.) // Nature : journal. — 1957. —
Vol. 179,
no. 4568. —
P. 988—991. — doi:10.1038/179988a0. — PMID 13430766.
↑
Rhys D. Evans, Lisa C. Heather. Metabolic pathways and abnormalities (англ.) // Surgery (Oxford). — 2016-06. —
Vol. 34,
iss. 6. —
P. 266–272. — doi:10.1016/j.mpsur.2016.03.010.
↑
Hudson H. Freeze, Gerald W. Hart, Ronald L. Schnaar. Glycosylation Precursors // Essentials of Glycobiology / Ajit Varki, Richard D. Cummings, Jeffrey D. Esko, Pamela Stanley, Gerald W. Hart, Markus Aebi, Alan G. Darvill, Taroh Kinoshita, Nicolle H. Packer, James H. Prestegard, Ronald L. Schnaar, Peter H. Seeberger. — Cold Spring Harbor (NY): Cold Spring Harbor Laboratory Press, 2015.
↑
Opdenakker G., Rudd P., Ponting C., Dwek R. Concepts and principles of glycobiology (англ.) //
The FASEB Journal
(англ.)
(
рус. : journal. —
Federation of American Societies for Experimental Biology
(англ.)
(
рус., 1993. —
Vol. 7,
no. 14. —
P. 1330—1337. — PMID 8224606.
↑
McConville M., Menon A. Recent developments in the cell biology and biochemistry of glycosylphosphatidylinositol lipids (review) (англ.) //
Mol Membr Biol
(англ.)
(
рус. : journal. — 2000. —
Vol. 17,
no. 1. —
P. 1—16. — doi:10.1080/096876800294443. — PMID 10824734.
↑
Chirala S., Wakil S. Structure and function of animal fatty acid synthase (англ.) // Lipids : journal. — 2004. —
Vol. 39,
no. 11. —
P. 1045—1053. — doi:10.1007/s11745-004-1329-9. — PMID 15726818.
↑
White S., Zheng J., Zhang Y. The structural biology of type II fatty acid biosynthesis (англ.) //
Annu Rev Biochem
(англ.)
(
рус. : journal. — 2005. —
Vol. 74. —
P. 791—831. — doi:10.1146/annurev.biochem.74.082803.133524. — PMID 15952903.
↑
Ohlrogge J., Jaworski J. Regulation of fatty acid synthesis (англ.) // Annu Rev Plant Physiol Plant Mol Biol : journal. — 1997. —
Vol. 48. —
P. 109—136. — doi:10.1146/annurev.arplant.48.1.109. — PMID 15012259.
↑
Dubey V., Bhalla R., Luthra R. An overview of the non-mevalonate pathway for terpenoid biosynthesis in plants (англ.) //
J Biosci
(англ.)
(
рус. : journal. — 2003. —
Vol. 28,
no. 5. —
P. 637—646. — doi:10.1007/BF02703339. — PMID 14517367.
↑ 1 2
Kuzuyama T., Seto H. Diversity of the biosynthesis of the isoprene units (англ.) //
Nat Prod Rep
(англ.)
(
рус. : journal. — 2003. —
Vol. 20,
no. 2. —
P. 171—183. — doi:10.1039/b109860h. — PMID 12735695.
↑
Grochowski L., Xu H., White R. Methanocaldococcus jannaschii uses a modified mevalonate pathway for biosynthesis of isopentenyl diphosphate (англ.) //
American Society for Microbiology
(англ.)
(
рус. : journal. — 2006. — May (
vol. 188,
no. 9). —
P. 3192—3198. — doi:10.1128/JB.188.9.3192-3198.2006. — PMID 16621811.
↑
Lichtenthaler H. The 1-Ddeoxy-D-xylulose-5-phosphate pathway of isoprenoid biosynthesis in plants (англ.) // Annu Rev Plant Physiol Plant Mol Biol : journal. — 1999. —
Vol. 50. —
P. 47—65. — doi:10.1146/annurev.arplant.50.1.47. — PMID 15012203.
↑ 1 2
Schroepfer G. Sterol biosynthesis (англ.) //
Annu Rev Biochem
(англ.)
(
рус. : journal. — 1981. —
Vol. 50. —
P. 585—621. — doi:10.1146/annurev.bi.50.070181.003101. — PMID 7023367.
↑
Lees N., Skaggs B., Kirsch D., Bard M. Cloning of the late genes in the ergosterol biosynthetic pathway of Saccharomyces cerevisiae—a review (англ.) // Lipids : journal. — 1995. —
Vol. 30,
no. 3. —
P. 221—226. — doi:10.1007/BF02537824. — PMID 7791529.
↑
R. Himmelreich, H. Hilbert, H. Plagens, E. Pirkl, B. C. Li. Complete sequence analysis of the genome of the bacterium Mycoplasma pneumoniae // Nucleic Acids Research. — 1996-11-15. —
Т. 24,
вып. 22. —
С. 4420–4449. — ISSN 0305-1048. — doi:10.1093/nar/24.22.4420.
↑
Guyton, Arthur C.; John E. Hall. Textbook of Medical Physiology (неопр.). — Philadelphia: Elsevier, 2006. — С. 855—856. — ISBN 0-7216-0240-1.
↑
Arthur C. Guyton. Textbook of medical physiology. — 11th ed. — Philadelphia: Elsevier Saunders, 2006. — xxxv, 1116 pages с. — ISBN 0-7216-0240-1, 978-0-7216-0240-0, 0-8089-2317-X, 978-0-8089-2317-6, 81-8147-920-3, 978-81-8147-920-4.
↑
Ibba M., Söll D. The renaissance of aminoacyl-tRNA synthesis (англ.) //
EMBO Rep
(англ.)
(
рус. : journal. — 2001. —
Vol. 2,
no. 5. —
P. 382—387. — PMID 11375928. Архивировано 1 мая 2011 года.
↑
Lengyel P., Söll D. Mechanism of protein biosynthesis (англ.) //
Microbiology and Molecular Biology Reviews
(англ.)
(
рус. : journal. —
American Society for Microbiology
(англ.)
(
рус., 1969. —
Vol. 33,
no. 2. —
P. 264—301. — PMID 4896351.
↑ 1 2
Rudolph F. The biochemistry and physiology of nucleotides (англ.) //
J Nutr
(англ.)
(
рус. : journal. — 1994. —
Vol. 124,
no. 1 Suppl. —
P. 124S—127S. — PMID 8283301.
↑
Zrenner R., Stitt M., Sonnewald U., Boldt R. Pyrimidine and purine biosynthesis and degradation in plants (англ.) // Annu Rev Plant Biol : journal. — 2006. —
Vol. 57. —
P. 805—836. — doi:10.1146/annurev.arplant.57.032905.105421. — PMID 16669783.
↑
Stasolla C., Katahira R., Thorpe T., Ashihara H. Purine and pyrimidine nucleotide metabolism in higher plants (англ.) // Plant Physiology : journal. — American Society of Plant Biologists, 2003. —
Vol. 160,
no. 11. —
P. 1271—1295. — doi:10.1078/0176-1617-01169. — PMID 14658380.
↑
Smith J. Enzymes of nucleotide synthesis (неопр.) // Curr Opin Struct Biol. — 1995. —
Т. 5,
№ 6. —
С. 752—757. — doi:10.1016/0959-440X(95)80007-7. — PMID 8749362.
↑
Testa B., Krämer S. The biochemistry of drug metabolism—an introduction: part 1. Principles and overview (англ.) // Chem Biodivers : journal. — 2006. —
Vol. 3,
no. 10. —
P. 1053—1101. — doi:10.1002/cbdv.200690111. — PMID 17193224.
↑
Danielson P. The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans (англ.) //
Curr Drug Metab
(англ.)
(
рус. : journal. — 2002. —
Vol. 3,
no. 6. —
P. 561—597. — doi:10.2174/1389200023337054. — PMID 12369887.
↑
King C., Rios G., Green M., Tephly T. UDP-glucuronosyltransferases (англ.) //
Curr Drug Metab
(англ.)
(
рус. : journal. — 2000. —
Vol. 1,
no. 2. —
P. 143—161. — doi:10.2174/1389200003339171. — PMID 11465080.
↑
Sheehan D., Meade G., Foley V., Dowd C. Structure, function and evolution of glutathione transferases: implications for classification of non-mammalian members of an ancient enzyme superfamily (англ.) //
Biochem J
(англ.)
(
рус. : journal. — 2001. — November (
vol. 360,
no. Pt 1). —
P. 1—16. — doi:10.1042/0264-6021:3600001. — PMID 11695986.
↑
Galvão T., Mohn W., de Lorenzo V. Exploring the microbial biodegradation and biotransformation gene pool (англ.) //
Trends Biotechnol
(англ.)
(
рус. : journal. — 2005. —
Vol. 23,
no. 10. —
P. 497—506. — doi:10.1016/j.tibtech.2005.08.002. — PMID 16125262.
↑
Janssen D., Dinkla I., Poelarends G., Terpstra P. Bacterial degradation of xenobiotic compounds: evolution and distribution of novel enzyme activities (англ.) // Environ Microbiol : journal. — 2005. —
Vol. 7,
no. 12. —
P. 1868—1882. — doi:10.1111/j.1462-2920.2005.00966.x. — PMID 16309386.
↑
Davies K. Oxidative stress: the paradox of aerobic life (неопр.) // Biochem Soc Symp. — 1995. —
Т. 61. —
С. 1—31. — PMID 8660387.
↑
Tu B., Weissman J. Oxidative protein folding in eukaryotes: mechanisms and consequences (англ.) //
J Cell Biol
(англ.)
(
рус. : journal. — 2004. —
Vol. 164,
no. 3. —
P. 341—346. — doi:10.1083/jcb.200311055. — PMID 14757749.
↑
Sies H. Oxidative stress: oxidants and antioxidants (англ.) //
Exp Physiol
(англ.)
(
рус. : journal. — 1997. —
Vol. 82,
no. 2. —
P. 291—295. — PMID 9129943. Архивировано 25 марта 2009 года.
↑
Vertuani S., Angusti A., Manfredini S. The antioxidants and pro-antioxidants network: an overview (англ.) //
Curr Pharm Des
(англ.)
(
рус. : journal. — 2004. —
Vol. 10,
no. 14. —
P. 1677—1694. — doi:10.2174/1381612043384655. — PMID 15134565.
↑
von Stockar U., Liu J. Does microbial life always feed on negative entropy? Thermodynamic analysis of microbial growth (англ.) //
Biochim Biophys Acta
(англ.)
(
рус. : journal. — 1999. —
Vol. 1412,
no. 3. —
P. 191—211. — doi:10.1016/S0005-2728(99)00065-1. — PMID 10482783.
↑
Demirel Y., Sandler S. Thermodynamics and bioenergetics (неопр.) // Biophys Chem. — 2002. —
Т. 97,
№ 2—3. —
С. 87—111. — doi:10.1016/S0301-4622(02)00069-8. — PMID 12050002.
↑
Albert R. Scale-free networks in cell biology (англ.) //
Journal of Cell Science
(англ.)
(
рус. : journal. —
The Company of Biologists
(англ.)
(
рус., 2005. —
Vol. 118,
no. Pt 21. —
P. 4947—4957. — doi:10.1242/jcs.02714. — PMID 16254242.
↑
Brand M. Regulation analysis of energy metabolism (англ.) // The Journal of Experimental Biology : journal. —
The Company of Biologists
(англ.)
(
рус., 1997. —
Vol. 200,
no. Pt 2. —
P. 193—202. — PMID 9050227.
↑
Soyer O., Salathé M., Bonhoeffer S. Signal transduction networks: topology, response and biochemical processes (англ.) //
J Theor Biol
(англ.)
(
рус. : journal. — 2006. —
Vol. 238,
no. 2. —
P. 416—425. — doi:10.1016/j.jtbi.2005.05.030. — PMID 16045939.
↑
Westerhoff H., Groen A., Wanders R. Modern theories of metabolic control and their applications (review) (англ.) // Biosci Rep : journal. — 1984. —
Vol. 4,
no. 1. —
P. 1—22. — doi:10.1007/BF01120819. — PMID 6365197.
↑
Salter M., Knowles R., Pogson C. Metabolic control (неопр.) // Essays Biochem. — 1994. —
Т. 28. —
С. 1—12. — PMID 7925313.
↑
Fell D., Thomas S. Physiological control of metabolic flux: the requirement for multisite modulation (англ.) //
Biochem J
(англ.)
(
рус. : journal. — 1995. —
Vol. 311,
no. Pt 1. —
P. 35—9. — PMID 7575476.
↑
Hendrickson W. Transduction of biochemical signals across cell membranes (англ.) // Q Rev Biophys : journal. — 2005. —
Vol. 38,
no. 4. —
P. 321—330. — doi:10.1017/S0033583506004136. — PMID 16600054.
↑
Cohen P. The regulation of protein function by multisite phosphorylation—a 25 year update (англ.) //
Trends Biochem Sci
(англ.)
(
рус. : journal. — 2000. —
Vol. 25,
no. 12. —
P. 596—601. — doi:10.1016/S0968-0004(00)01712-6. — PMID 11116185.
↑
Lienhard G., Slot J., James D., Mueckler M. How cells absorb glucose (неопр.) // Sci Am. — 1992. —
Т. 266,
№ 1. —
С. 86—91. — doi:10.1038/scientificamerican0192-86. — PMID 1734513.
↑
Roach P. Glycogen and its metabolism (англ.) //
Curr Mol Med
(англ.)
(
рус. : journal. — 2002. —
Vol. 2,
no. 2. —
P. 101—120. — doi:10.2174/1566524024605761. — PMID 11949930.
↑
Newgard C., Brady M., O'Doherty R., Saltiel A. Organizing glucose disposal: emerging roles of the glycogen targeting subunits of protein phosphatase-1 (англ.) // Diabetes : journal. — 2000. —
Vol. 49,
no. 12. —
P. 1967—1977. — doi:10.2337/diabetes.49.12.1967. — PMID 11117996.
↑
Romano A., Conway T. Evolution of carbohydrate metabolic pathways (неопр.) // Res Microbiol. — 1996. —
Т. 147,
№ 6—7. —
С. 448—455. — doi:10.1016/0923-2508(96)83998-2. — PMID 9084754.
↑
Koch A. How did bacteria come to be? (англ.) //
Advances in Microbial Physiology
(англ.)
(
рус. : journal. — Academic Press, 1998. —
Vol. 40. —
P. 353—399. — doi:10.1016/S0065-2911(08)60135-6. — PMID 9889982.
↑
Ouzounis C., Kyrpides N. The emergence of major cellular processes in evolution (англ.) //
FEBS Lett
(англ.)
(
рус. : journal. — 1996. —
Vol. 390,
no. 2. —
P. 119—123. — doi:10.1016/0014-5793(96)00631-X. — PMID 8706840.
↑
Caetano-Anolles G., Kim H. S., Mittenthal J. E. The origin of modern metabolic networks inferred from phylogenomic analysis of protein architecture (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2007. —
Vol. 104,
no. 22. —
P. 9358—9363. — doi:10.1073/pnas.0701214104. — PMID 17517598.
↑
Schmidt S., Sunyaev S., Bork P., Dandekar T. Metabolites: a helping hand for pathway evolution? (англ.) //
Trends Biochem Sci
(англ.)
(
рус. : journal. — 2003. —
Vol. 28,
no. 6. —
P. 336—341. — doi:10.1016/S0968-0004(03)00114-2. — PMID 12826406.
↑
Light S., Kraulis P. Network analysis of metabolic enzyme evolution in Escherichia coli (англ.) //
BMC Bioinformatics
(англ.)
(
рус. : journal. — 2004. —
Vol. 5. —
P. 15. — doi:10.1186/1471-2105-5-15. — PMID 15113413.
Alves R., Chaleil R., Sternberg M. Evolution of enzymes in metabolism: a network perspective (англ.) //
J Mol Biol
(англ.)
(
рус. : journal. — 2002. —
Vol. 320,
no. 4. —
P. 751—770. — doi:10.1016/S0022-2836(02)00546-6. — PMID 12095253.
↑
Kim H. S., Mittenthal J. E., Caetano-Anolles G. MANET: tracing evolution of protein architecture in metabolic networks (англ.) //
BMC Bioinformatics
(англ.)
(
рус. : journal. — 2006. —
Vol. 19,
no. 7. —
P. 351. — doi:10.1186/1471-2105-7-351. — PMID 16854231.
↑
Teichmann S. A., Rison S. C., Thornton J. M., Riley M., Gough J., Chothia C. Small-molecule metabolsim: an enzyme mosaic (англ.) //
Trends Biotechnol
(англ.)
(
рус. : journal. — 2001. —
Vol. 19,
no. 12. —
P. 482—486. — doi:10.1016/S0167-7799(01)01813-3. — PMID 11711174.
↑
Spirin V., Gelfand M., Mironov A., Mirny L. A metabolic network in the evolutionary context: multiscale structure and modularity (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2006. — June (
vol. 103,
no. 23). —
P. 8774—8779. — doi:10.1073/pnas.0510258103. — PMID 16731630.
↑
Lawrence J. Common themes in the genome strategies of pathogens (англ.) // Curr Opin Genet Dev : journal. — 2005. —
Vol. 15,
no. 6. —
P. 584—588. — doi:10.1016/j.gde.2005.09.007. — PMID 16188434.
Wernegreen J. For better or worse: genomic consequences of intracellular mutualism and parasitism (англ.) // Curr Opin Genet Dev : journal. — 2005. —
Vol. 15,
no. 6. —
P. 572—583. — doi:10.1016/j.gde.2005.09.013. — PMID 16230003.
↑
Pál C., Papp B., Lercher M., Csermely P., Oliver S., Hurst L. Chance and necessity in the evolution of minimal metabolic networks (англ.) // Nature : journal. — 2006. —
Vol. 440,
no. 7084. —
P. 667—670. — doi:10.1038/nature04568. — PMID 16572170.
↑
Rennie M. An introduction to the use of tracers in nutrition and metabolism (англ.) // Proc Nutr Soc : journal. — 1999. —
Vol. 58,
no. 4. —
P. 935—944. — doi:10.1017/S002966519900124X. — PMID 10817161.
↑
Phair R. Development of kinetic models in the nonlinear world of molecular cell biology (англ.) // Metabolism : journal. — 1997. —
Vol. 46,
no. 12. —
P. 1489—1495. — doi:10.1016/S0026-0495(97)90154-2. — PMID 9439549.
↑
Sterck L., Rombauts S., Vandepoele K., Rouzé P., Van de Peer Y. How many genes are there in plants (... and why are they there)? (англ.) // Curr Opin Plant Biol : journal. — 2007. —
Vol. 10,
no. 2. —
P. 199—203. — doi:10.1016/j.pbi.2007.01.004. — PMID 17289424.
↑
Borodina I., Nielsen J. From genomes to in silico cells via metabolic networks (англ.) // Curr Opin Biotechnol : journal. — 2005. —
Vol. 16,
no. 3. —
P. 350—355. — doi:10.1016/j.copbio.2005.04.008. — PMID 15961036.
↑
Gianchandani E., Brautigan D., Papin J. Systems analyses characterize integrated functions of biochemical networks (англ.) //
Trends Biochem Sci
(англ.)
(
рус. : journal. — 2006. —
Vol. 31,
no. 5. —
P. 284—291. — doi:10.1016/j.tibs.2006.03.007. — PMID 16616498.
↑
Duarte N. C., Becker S. A., Jamshidi N., et al. Global reconstruction of the human metabolic network based on genomic and bibliomic data (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2007. — February (
vol. 104,
no. 6). —
P. 1777—1782. — doi:10.1073/pnas.0610772104. — PMID 17267599.
↑
Goh K. I., Cusick M. E., Valle D., Childs B., Vidal M., Barabási A. L. The human disease network (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2007. — May (
vol. 104,
no. 21). —
P. 8685—8690. — doi:10.1073/pnas.0701361104. — PMID 17502601.
↑
Lee D. S., Park J., Kay K. A., Christakis N. A., Oltvai Z. N., Barabási A. L. The implications of human metabolic network topology for disease comorbidity (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2008. — July (
vol. 105,
no. 29). —
P. 9880—9885. — doi:10.1073/pnas.0802208105. — PMID 18599447.
↑
Csete M., Doyle J. Bow ties, metabolism and disease (англ.) //
Trends Biotechnol.
(англ.)
(
рус. : journal. — 2004. —
Vol. 22,
no. 9. —
P. 446—450. — doi:10.1016/j.tibtech.2004.07.007. — PMID 5249808.
↑
Ma H. W., Zeng A. P. The connectivity structure, giant strong component and centrality of metabolic networks (англ.) // Bioinformatics : journal. — 2003. —
Vol. 19,
no. 11. —
P. 1423—1430. — doi:10.1093/bioinformatics/btg177. — PMID 12874056.
↑
Zhao J., Yu H., Luo J. H., Cao Z. W., Li Y. X. Hierarchical modularity of nested bow-ties in metabolic networks (англ.) //
BMC Bioinformatics
(англ.)
(
рус. : journal. — 2006. —
Vol. 7. —
P. 386. — doi:10.1186/1471-2105-7-386. — PMID 16916470.
↑
Thykaer J., Nielsen J. Metabolic engineering of beta-lactam production (англ.) //
Metab Eng
(англ.)
(
рус. : journal. — 2003. —
Vol. 5,
no. 1. —
P. 56—69. — doi:10.1016/S1096-7176(03)00003-X. — PMID 12749845.
González-Pajuelo M., Meynial-Salles I., Mendes F., Andrade J., Vasconcelos I., Soucaille P. Metabolic engineering of Clostridium acetobutylicum for the industrial production of 1,3-propanediol from glycerol (англ.) //
Metab Eng
(англ.)
(
рус. : journal. — 2005. —
Vol. 7,
no. 5—6. —
P. 329—336. — doi:10.1016/j.ymben.2005.06.001. — PMID 16095939.
Krämer M., Bongaerts J., Bovenberg R., Kremer S., Müller U., Orf S., Wubbolts M., Raeven L. Metabolic engineering for microbial production of shikimic acid (англ.) //
Metab Eng
(англ.)
(
рус. : journal. — 2003. —
Vol. 5,
no. 4. —
P. 277—283. — doi:10.1016/j.ymben.2003.09.001. — PMID 14642355.
↑
Koffas M., Roberge C., Lee K., Stephanopoulos G. Metabolic engineering (неопр.) //
Annu Rev Biomed Eng
(англ.)
(
рус.. — 1999. —
Т. 1. —
С. 535—557. — doi:10.1146/annurev.bioeng.1.1.535. — PMID 11701499.
↑
Фельдман Г.Э. Майкл Фостер. — Ленинград: Наука, 1986. — С. 52.
↑
Dr. Abu Shadi Al-Roubi (1982), «Ibn Al-Nafis as a philosopher», Symposium on Ibn al Nafis, Second International Conference on Islamic Medicine: Islamic Medical Organization, Kuwait (cf. Ibnul-Nafees As a Philosopher, Encyclopedia of Islamic World [1]).
↑
Eknoyan G. Santorio Sanctorius (1561—1636) — founding father of metabolic balance studies (англ.) // Am J Nephrol : journal. — 1999. —
Vol. 19,
no. 2. —
P. 226—233. — doi:10.1159/000013455. — PMID 10213823.
↑
Williams, H. S. (1904) A History of Science: in Five Volumes. Volume IV: Modern Development of the Chemical and Biological Sciences Архивная копия от 9 мая 2012 на Wayback Machine Harper and Brothers (New York) Retrieved on 2007-03-26
↑
Dubos J. Louis Pasteur: Free Lance of Science, Gollancz. Quoted in Manchester K. L. (1995) Louis Pasteur (1822–1895)—chance and the prepared mind (англ.) //
Trends Biotechnol
(англ.)
(
рус. : journal. — 1951. —
Vol. 13,
no. 12. —
P. 511—515. — doi:10.1016/S0167-7799(00)89014-9. — PMID 8595136.
↑
Kinne-Saffran E., Kinne R. Vitalism and synthesis of urea. From Friedrich Wöhler to Hans A. Krebs (англ.) // Am J Nephrol : journal. — 1999. —
Vol. 19,
no. 2. —
P. 290—294. — doi:10.1159/000013463. — PMID 10213830.
↑
Eduard Buchner’s 1907 Nobel lecture Архивная копия от 8 июля 2017 на Wayback Machine at http://nobelprize.org Архивная копия от 5 апреля 2006 на Wayback Machine Accessed 2007-03-20
↑
Kornberg H. Krebs and his trinity of cycles (англ.) // Nat Rev Mol Cell Biol : journal. — 2000. —
Vol. 1,
no. 3. —
P. 225—228. — doi:10.1038/35043073. — PMID 11252898.
↑
Krebs H. A., Henseleit K. Untersuchungen über die Harnstoffbildung im tierkorper (нем.) //
Z. Physiol. Chem.
(англ.)
(
рус. : magazin. — 1932. —
Bd. 210. —
S. 33—66.
Krebs H., Johnson W. Metabolism of ketonic acids in animal tissues (англ.) //
Biochem J
(англ.)
(
рус. : journal. — 1937. — April (
vol. 31,
no. 4). —
P. 645—660. — PMID 16746382.
![]()
![]() Ссылки
Ссылки![]() Править
Править
- А. Г. Малыгин. Обмен веществ (метаболизм). (рус.) // chemport.ru
- Dr. R. E. Hurlbert. Chapter VII: Metabolism and Biochemistry. — Microbial Metabolism (1999). (англ.) // webarchive.loc.gov
B. И. Розенгарт, P. А. Зарембский (энд.), B. B. Фролькие (гер.), Ю. E. Вельтищев (у детей). «Обмен веществ и энергии». (рус.) // «Большая медицинская энциклопедия» под редакцией Петровского Б. В., 3-е издание. — М., 1974—1989. —
Т. 17. Дата обращения: 18 января 2022.







